ETHAN, que vive con Duchenne.
Estrategias de investigación dirigidas a la producción de distrofina
En un esfuerzo por mejorar la atención de las personas que viven con Duchenne, los investigadores están trabajando para desarrollar una gama de posibles opciones nuevas para el control de Duchenne. Algunas de estas ya están en ensayos clínicos, mientras que otras se encuentran en etapas iniciales de desarrollo.
Los enfoques prometedores pasan por una extensa revisión y aprobación de la Administración de Alimentos y Medicamentos de EE. UU. (consulte Desarrollo de fármacos y aprobación de la FDA) antes de que estén disponibles para los pacientes fuera de ensayos clínicos.
El objetivo de algunos de estos enfoques experimentales es abordar la causa de Duchenne, la ausencia de la proteína distrofina, restaurando la producción de una forma funcional de distrofina.
Terapia genética
¿Qué es la terapia genética?
Una opción de tratamiento para Duchenne actualmente en desarrollo se denomina terapia genética. El objetivo de la terapia genética es aportar una nueva versión del gen de la distrofina en las células afectadas por la enfermedad.
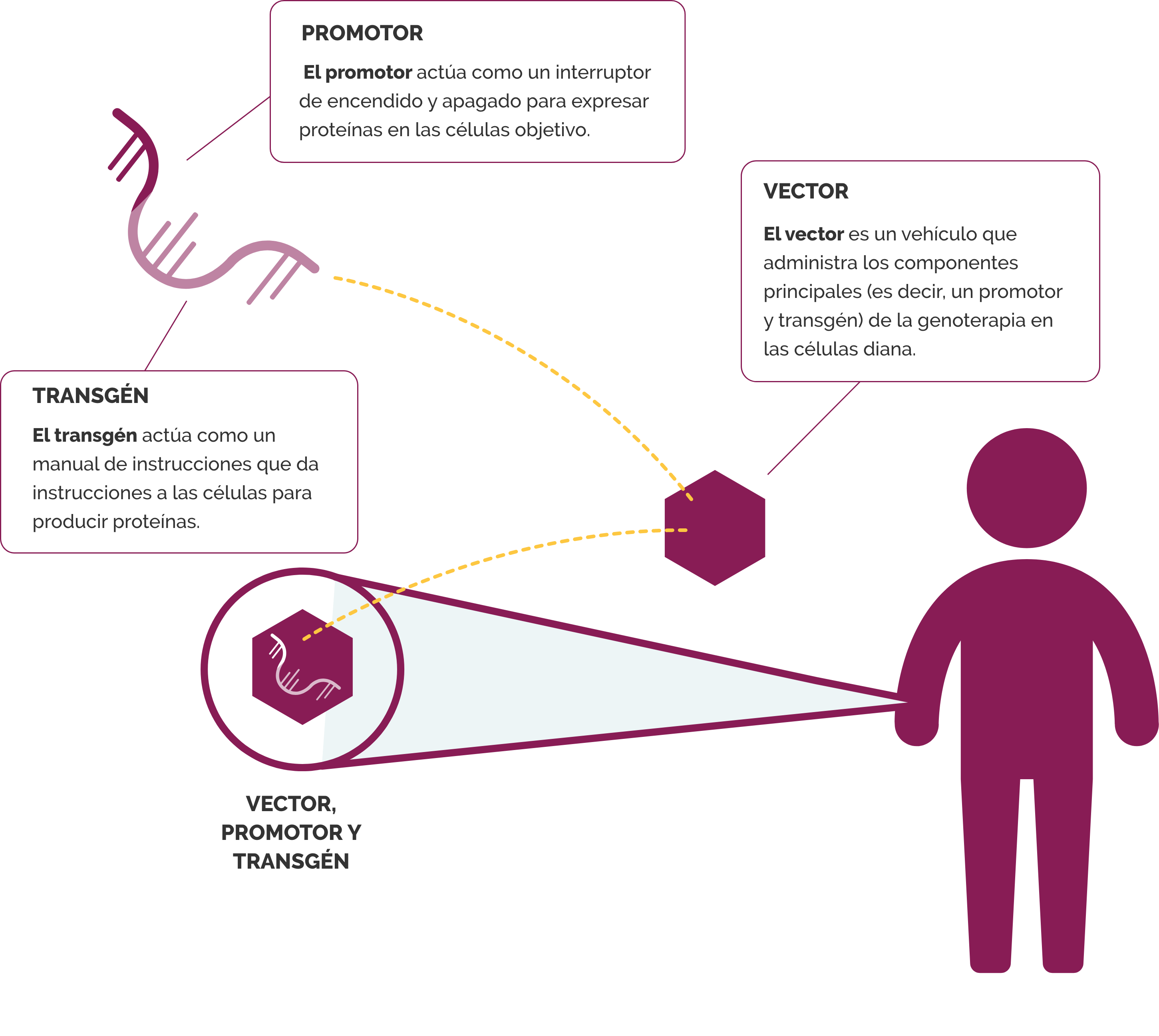
Al diseñar una terapia genética, los investigadores necesitan una manera de introducir el nuevo gen en las células objetivo. Lo hacen mediante el desarrollo de tres componentes principales de la terapia genética: el vector, el promotor y el transgén. Los científicos seleccionan cuidadosamente cada uno de estos componentes y luego realizan pruebas para determinar si su terapia genética está funcionando según lo previsto.
¿Cuáles son los componentes clave de la terapia genética?
Cada terapia de transferencia genética está compuesta por tres componentes clave: el vector, el promotory el transgén
Anticuerpos y terapia genética
Antes de recibir terapia genética, se debe evaluar la elegibilidad de las personas en función de factores como la edad, el tipo de mutación genética, la movilidad y función iniciales, y la exposición previa a una terapia en investigación o disponible comercialmente. Los pacientes también deben ser evaluados para detectar anticuerpos preexistentes, para comprender si han estado expuestos previamente al virus que se usa como vector en la terapia genética.
Las personas pueden desarrollar anticuerpos preexistentes que reconocen a un vector de la terapia genética, incluso si nunca antes han recibido una terapia genética. Algunos virus presentes naturalmente en el medio ambiente son similares a los vectores utilizados en la terapia genética, y si se expone, el sistema inmunitario de una persona puede producir anticuerpos contra el virus que también reconocen al vector.
Actualmente, no hay ninguna manera de evitar el desarrollo de estos anticuerpos naturales o de saber si una persona ha estado expuesta a uno de estos virus sin una prueba de anticuerpos.
Los científicos están trabajando para seleccionar vectores que ayudarán al transgén y al promotor a ingresar en las células correctas, reduciendo el riesgo de una respuesta inmunitaria. En este momento, las pruebas de anticuerpos son la única manera de determinar si una persona tiene anticuerpos preexistentes que podrían impedir que una terapia genética funcione según lo previsto.
Edición genética
La edición genética es una técnica experimental que se encuentra en las primeras fases de desarrollo. El objetivo de esta investigación es cambiar los componentes básicos específicos del gen de la distrofina, como cambiar las letras en un manual de instrucciones, para que las células puedan producir distrofina. Estas estrategias utilizan una técnica llamada CRISPR/Cas (también llamada CRISPR/Cas9 o CRISPR) para la edición de genes.
Una manera en que los investigadores usan CRISPR es eliminar los “errores” en el gen de la distrofina en las células cardíacas y musculares, de forma que las células puedan ahora leer el gen y producir la proteína distrofina. En otra posible estrategia se utiliza CRISPR para reemplazar los errores en el gen de la distrofina con partes de un gen sano, con el objetivo de restaurar la capacidad de la célula de producir distrofina.
La edición genética con CRISPR también se está explorando en células madre musculares en Duchenne. Los investigadores están editando el gen de la distrofina en células madre musculares, e investigan si se pueden convertir en nuevas células musculares que producen distrofina. El objetivo final es regenerar un músculo sano para reemplazar el músculo debilitado en Duchenne.
Enfoques emergentes de omisión de exones
Los oligómeros de morfolino fosforodiamidato, o PMO, son moléculas sintéticas modeladas según el marco natural del ARN. Actualmente hay cuatro PMO aprobados por la FDA. Estos PMO abordan las deleciones en tres exones que son deleciones comunes en Duchenne. Se están desarrollando terapias con PMO adicionales para abordar las deleciones en otros exones.
Los oligómeros de morfolino fosforodiamidato (PPMO) peptídicos en investigación son similares a los enfoques de omisión de exones de los PMO, pero tienen un elemento adicional: un péptido (proteína pequeña) que puede ayudar a que la terapia de omisión de exones ingrese en las células.